长春长生两年前也曾被查出21万人份疫苗不合格!事关人命,这些问题谁来回答
今天,长春长生生物科技有限责任公司(下称“长春长生”)的问题疫苗事件仍在持续发酵。南都君的朋友圈、微信群、QQ群被相关事件刷爆了!
南都君部分微信群、QQ群截图
今早热搜榜三个话题
对公众来说,事关人命,诸多疑问未解:
长春长生25万只百白破问题疫苗流向何方?
打了问题疫苗的会有什么反应?
现在打国产疫苗还安全吗?
怎么知道是否打了问题疫苗呢?
打了问题疫苗要不要补种呢?
为什么时隔近9个月才披露处罚结果?
……
两年前就被查出21万人份疫苗不合格
实际上,除长春长生在去年11月被抽查出有252600支不合格百白破疫苗外,武汉生物制品研究所有限责任公司生也在同时段被查出有400520支百白破不合格疫苗。
澎湃新闻还发现,2016年长春长生另外还有一批21.0048 万人份的百白破疫苗因质量不合格被拒签。
中检院发布的《2016年生物制品批签发年报》显示,2016年,疫苗签发51个品种、共3950批次,其中3949批符合规定、1批不符合规定(不合格率为0.25‰)。拒签的1批疫苗(210048人份)为长春长生生物科技股份有限公司生产的吸附无细胞百白破联合疫苗,不合格项目为无细胞百日咳疫苗效价测定。
上述年报亦称,2016年我国签发的疫苗3949批约计6.46亿人份,批签发不合格率为0.03%;除2015年外,历年不合格率均低于0.5%,表明疫苗制品质量稳定,不合格制品较少。国产疫苗成为上市疫苗主体,支撑国家免疫规划实施。
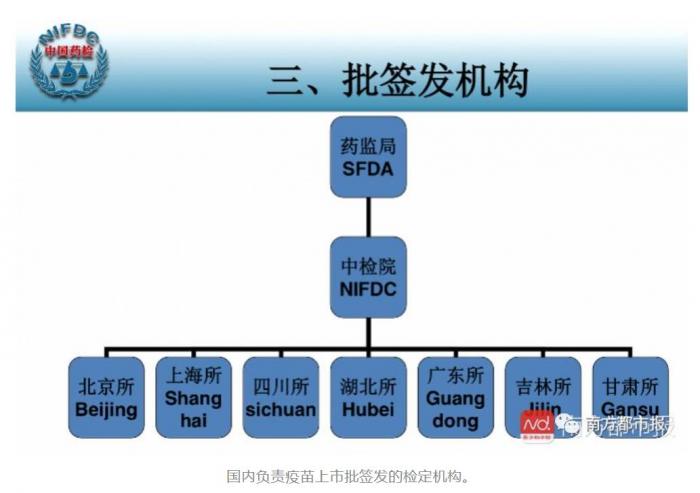
疫苗从生产到出厂如何监管?
虽有批签发制度,上市疫苗为何仍有“漏网之鱼”
事件曝光、舆论关注之后,公众也开始担心疫苗安全质量。那么,国内对疫苗的监管体系是怎么样的?
实际上,在我国上市的疫苗,无论是国产疫苗还是进口疫苗,都必须严格按照国家药监局的要求,进行严格的上市前临床研究,才能获得批准上市。企业生产也都必须符合药品生产质量管理规范(GMP)要求。
此外,每一批国产疫苗和进口疫苗在上市流通前,都要经过一道十分严苛的“关卡”——批签发合格后才能上市使用。
批签发制度的全称是“生物制品批签发”。国家对疫苗类制品、血液制品、用于血源筛查的体外诊断试剂,以及药监部门规定的其他生物制品,在每批产品上市销售前或者进口时,指定药品检验机构进行资料审核、现场核实、样品检验的监督管理行为。
在批签发制度要求下,企业生产的每一批疫苗,都要经抽样、送检、资料审核及检验合格之后,才能上市。检验不合格或者审核不符合规定,不得上市或进口。
对于最受关注的疫苗各个效价是否有效的问题,需要通过动物实验来检定。以百白破疫苗为例,要对白喉、百日咳、破伤风三个效价分别做动物实验。
整个过程是这样的:首先将疫苗接种到小鼠(或其他实验动物)身上,等4-6周时间(动物和人一样,产生免疫力需要一个过程),然后再将过量的致病性的微生物注入小鼠体内(行业内成为“攻毒”),评估经免疫的实验动物的疫苗保护作用。这个过程大致是模拟人体接种疫苗后受到病原微生物感染的过程,从而得出对疫苗效力的评价。
疫苗的批签发制度,正是为了尽可能保证在市场上流通的疫苗是安全和有效的。因此,经过批签发的国产和进口的同种疫苗,在质量标准、安全性和使用上没有明显的差别。
不过,据南都记者了解,批签发制度中疫苗的各个检定项目(如体内外的效力、安全性、理化检验等)并不是每一批疫苗100%全都要做,因而有的时候,经过批签发上市的疫苗仍然会有“漏网之鱼”,比如去年发现的两批次百白破疫苗。
国产疫苗问题更严重吗?
从批签发环节看,进口疫苗的问题也不小
2011年和2014年,中国疫苗监管体系两次通过世界卫生组织(WHO)的国家监管体系评估(NRA)。批签发制度是监管体系当中的重要内容。
中国食品药品检定研究院生物制品检定所所长沈琦告诉南都记者,按照国际惯例,所有疫苗,包括中国出口到世界其他国家的疫苗,也都需要经过批签发才能上市流通。
批签发制度作为疫苗上市的一道重要关卡,能够有效筛查出大部分质量存在问题的疫苗(不管是国产还是进口),并阻拦其进入市场流通。
从2017年的情况看,在批签发环节发现的问题中,进口疫苗的问题也不小。
从批签发的情况看,2017年进口疫苗比国产疫苗的问题要多。2017年有2批国产疫苗和14批进口疫苗不符合规定,不合格批次多于2016年,主要是进口疫苗不合格批次增多所致。
其中16批被批签发阻拦的疫苗中,有7批不符合规定的疫苗是狂犬疫苗。其中1批为国产,6批为进口。
其中广州诺诚生物制品股份有限公司生产的1批冻干人用狂犬病疫苗(Vero细胞)和凯荣-贝林公司(境外企业)生产的2批人用狂犬病疫苗(鸡胚细胞)的效力试验不符合规定;凯荣-贝林公司生产的4批人用狂犬病疫苗(鸡胚细胞)的细菌内毒素和热原检查项不符合规定。
在批签发发现问题后,国家药监局启动对凯荣-贝林公司生产的人用狂犬病疫苗(鸡胚细胞)的市场专项抽验,即对已经签发上市的疫苗进行市场监督抽验,检验结果均符合规定。
“这说明批签发能够有效阻止不合格产品流入市场。”《2017年生物制品批签发年报》称。
此外,2017年,中检院在对赛诺菲巴斯德公司生产的36批吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(五联苗)进行批签发检验中,发现8批(约计71.50万人份)疫苗的破伤风效力不符合规定,存在较高质量风险。
发现问题后,依据我国相关法规及《药品生产质量管理规范》,原食药监总局会同中检院约谈了赛诺菲巴斯德公司,要求赛诺菲巴斯德公司对五联苗的生产、质量控制进行全面彻底的自查并提交整改报告,在确定消除质量风险前暂停五联苗的批签发进口。
赛诺菲巴斯德公司认为更换铝佐剂供应商是造成破伤风疫苗效价下降的主要原因,承诺对五联苗进行全面的风险评估和质量分析,提交改进措施,并主动撤回正在进行批签发检验的其他全部批次产品。这起事件也说明我国批签发系统的敏感性很高,可以及时发现并有效防范不符合国家标准规定的产品上市销售,切实保障安全。
上市后,政府如何监管疫苗?
问题疫苗的后续处置信息仍需及时披露
经过批签发上市之后的疫苗怎么监管?一种监管手段是上市后的监督抽检。
2017年百白破疫苗效价不合格虽然没有在批签发环节发现,但是通过国家在疫苗上市后的主动质量监测活动发现。
“抽检发现效价不合格问题后,药监部门立即对企业开展了生产现场飞行检查,发现两家公司在产品分包装阶段生产质量管理存在问题,已经要求企业整改。”中检院一名了解情况的工作人员告诉记者,当时的食药监总局向相关省局发出通知,要求两个省局高度重视,监督企业迅速查清不合格批次产品销售流向,使用信息和数量,监督企业切实履行产品召回责任。
不过,考虑到疫苗是预防、控制传染病发生和流行,用于人体免疫接种的生物制品,一旦事后才发现接种的疫苗质量不合格,那造成的健康风险是巨大的,想要挽回,也会耗费巨额成本。
疫苗专家陶黎纳介绍,2017年11月有关部门在通告中表示,“抽取两家企业生产所有在有效期内的百白破疫苗样品进行检验,检验结论需6-8周作出。国家卫生计生委和3省市卫生计生部门正在组织专家对接种这2批次疫苗的保护效果进行评估,根据评估结果采取相应措施妥善处理。我们将及时向社会公布有关信息。”
然而,目前,对于2017年不合格百白破疫苗在市场流通后的健康风险如何评估,药监部门和疾控部门如何处置,还没有详细信息披露,这在一定程度上也导致了公众对疫苗监管工作的怀疑态度,期待有关部门尽快公开发布有关信息。
其中,有关信息就应包括告知公众是否需要补种相关疫苗。
陶黎纳介绍,效价不合格并不必然导致保护力下降。如果百日咳效价合格的标准是60分,实际检测结果是58分,虽然确实不合格,但2分之差,在接种人体产生免疫力时未必有实质性区别。
官方迟迟没有给出需要补种的意见,陶黎纳推测官方的实际态度是无需补种。“白百破疫苗是儿童免费接种的疫苗种类中不良反应最多的疫苗,因此补种该疫苗需要更加谨慎。”陶黎纳说。
飞行检查和常规检查有和区别?
2018年7月通报的长春长生狂犬疫苗是通过飞行检查发现的。国家药监局的公告中表示,“此次飞行检查所有涉事批次产品,尚未出厂和上市销售,全部产品已得到有效控制。”
一位疫苗行业内部人士向南都记者分析称,“本次事件应该是内部举报,国家药监局有因检查,所以暂时仅涉及涉事批次。”
据媒体报道,内部举报一直以来也是成为发动飞检的一大动因。这类原因导致的飞行检查,企业的失败率也非常高。原因有二,一方面,飞行检查组是有针对性和目标性的,到了工厂后会直奔问题点;另一方面,投诉举报或者在特定事件中,药监部门可能已经掌握了企业的一些证据,所以飞检失败的可能性非常大。
据了解,开展飞行检查的保密性极高,工作人员事先并不知道要查哪个企业,飞到企业所在城市后,才会拿到一个信封知晓被查对象
相关报道
患者注射狂犬疫苗后几近失明
生产疫苗的长春长生被判无责
澎湃新闻从中国裁判文书网获悉,长春长生公司此前曾涉入一起狂犬疫苗致患者残疾民事诉讼案,整个诉讼过程超过十年。
2005年,山东省青州市一名男子被犬咬伤后,到卫生所注射狂犬疫苗,随后其双目几近失明——二级残疾。司法鉴定结果称,其症状与其注射狂犬疫苗存在关联性。涉案疫苗由长春长生公司生产。
2006年,该男子起诉涉事卫生所所属公司——山东润光液压科技股份有限公司(简称“润光公司”)索赔。法院判决润光公司赔偿该男子共计约76.5万元。
随后,润光公司起诉长春长生公司索赔。
一审和二审法院均判决长春长生公司承担润光公司经济损失的80%(约61.2万元),但再审法院山东省高级人民法院(下称“山东省高院”)撤销上述判决。长春长生公司最终没有担责。
判决书显示,长春长生公司未能提供涉案疫苗(或所属批次疫苗)的检验合格证明。
司法鉴定:
症状符合“罕见不良反应”特点,属于“医疗意外”
山东省高级人民法院的终审判决书显示,2005年6月22日,夏某某因被自家饲养的小狗咬伤,到润光公司的卫生所注射狂犬疫苗,共注射3针。
2005年7月11日,夏某某视力下降,到潍坊市益都中心医院检查显示:其右眼无光感,右眼视力为0.1。
2006年10月27日,夏某某起诉润光公司,潍坊市中级人民法院根据夏某某的申请,依法委托北京法源科学证据鉴定中心进行司法鉴定。
司法鉴定结论主要包括:
1、被鉴定人目前主要为免疫介导的脑白质炎症导致的视神经炎所致视力障碍症状,并且存在一定肢体腱反射活跃症状。
2、被鉴定人脑部病变与其注射狂犬疫苗存在关联性,该症状符合狂犬疫苗导致颅脑变态反应炎症的罕见不良反应特点,该现象属于医疗意外情形。对被鉴定人进行狂犬疫苗注射未违反医疗常规。
3、被鉴定人目前状况符合二级残疾之情形,住院期间需一人护理,出院后生活上需一人护理。
4、被鉴定人目前的脑部症状缺乏明确有效的特异性治疗方案。
根据潍坊市中级人民法院、潍城区人民法院的判决,润光公司共计赔偿夏某某损失76.539055万元。
长春长生未能提供批签发合格证明
但最终被判无责
随后,润光公司起诉疫苗生产厂家长春长生公司和售出该疫苗的青州市疾病预防控制中心,进行索赔。
一审法院青州市人民法院认为,根据《产品质量法》第26条、第27条规定,生产者应对其生产的产品质量负责,并有提供产品质量检验合格证明的法定义务。在涉案疫苗已经造成严重损害后果,且长春长生公司有能力、有义务提供涉案疫苗检验合格证明的情况下,该公司未能提供该批次疫苗的检验合格证明。长生公司依法应承担相应责任。
青州市人民法院一审判决,长春长生公司承担润光公司经济损失的80%:于判决生效之日起十日内支付润光公司61.231244万元。
长春长生公司提出上诉。
2014年1月,二审法院潍坊市中级人民法院驳回长春长生公司的上诉请求,维持原判。
随后,长春长生公司向山东省高级人民法院(简称“山东省高院”)申请再审。
2016年9月,山东省高院作出终审判决:撤销一审法院和二审法院的民事判决,驳回润光公司的诉讼请求,并由润光公司承担一审和二审的案件受理费用。
在已公示的判决书中,山东省高院称,二审法院委托的司法鉴定机构并非进行预防接种异常反应鉴定的法定机构,其出具的鉴定结果虽明确,但不能作为认定构成预防接种异常反应的定案依据。
此外,山东省高院判决书称,“应认定涉案狂犬医疗为合格医疗产品。”虽然长春长生公司未能提供涉案狂犬疫苗的批签发合格证明,但事发时法律尚未实施人用狂犬疫苗批签发管理的强制性规定。在庭审中,负有举证责任的润光公司也未能提供证据,证明涉案疫苗有缺陷。而且前述司法鉴定机构出具的鉴定结论也未说明涉案狂犬疫苗为不合格产品。
前述司法鉴定机构在鉴定结论中称,“对于疫苗质量的评定超出本鉴定的能力范围。”
山东省高院的终审判决书显示,长春长生公司以“不能排除润光公司卫生所从其他销售者处购买的产品或假冒伪劣产品”为由,否认涉案狂犬疫苗为该公司生产。
但法院未予采信。
青州市疾控中心也称,在青州,确有非法销售狂犬疫苗现象的存在。
山东省高院审理认为,长生公司未能提供反驳证据,润光公司、青州市疾控中心购买的数量、时间与涉案狂犬疫苗高度吻合,能够证明润光公司为夏某某注射的疫苗为长生公司生产。
南方都市报(nddaily)综合报道
南都记者:吴斌 实习生 郝丽华
另据澎湃新闻(thepapernews 记者:吴跃伟 刘楚 南都君已获授权转载)
(编辑:毕凤至)
 分享成功
分享成功