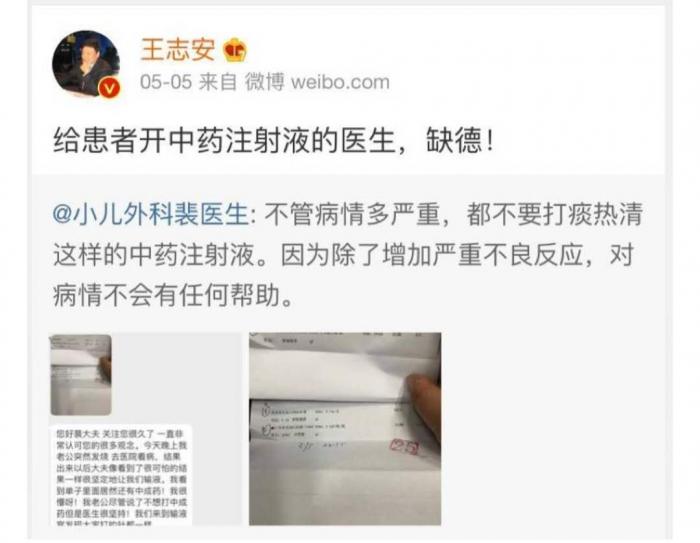
随着斯坦福招生舞弊案不断发酵,将步长制药与其主打药品丹红注射液等推上风口浪尖。近日,媒体人王志安发表的“开中药注射液缺德论”在微博上掀起一阵狂风暴雨。
中药注射液是在中国特定时代的产物。建国后,由于缺医少药,疾病肆虐,中药注射剂就在这种情况下应运而生,在上个世纪六七十年代,中药注射剂快速发展,到了上世纪八十年代,已经研发出1400多种中药注射剂。
但由于历史以及临床原因,目前90%以上中药注射液都被淘汰了。2015年版中国药典只收录了5种中药注射剂,包括止喘灵注射液、注射用双黄连(冻干)、清开灵注射液、灯盏细辛注射液和注射用灯盏花素。
其中,灯盏花素氯化钠注射液系步长制药独家生产的,治疗范围涵盖:缺血性脑血管疾病,如脑梗塞,脑出血后遗症所导致的偏瘫;冠心病、心绞痛、心肌梗塞以及高粘血症等疾病。该产品2018年的收入为0.26亿元。
根据2017年公立医院中成药的销售情况,排名前20的中成药中,16个为注射液,主要的上市企业有中恒集团(梧州制药)、步长制药、昆药集团、振东制药、丽珠集团等,销售最高的依然是梧州制药的注射用血栓通,73亿元。
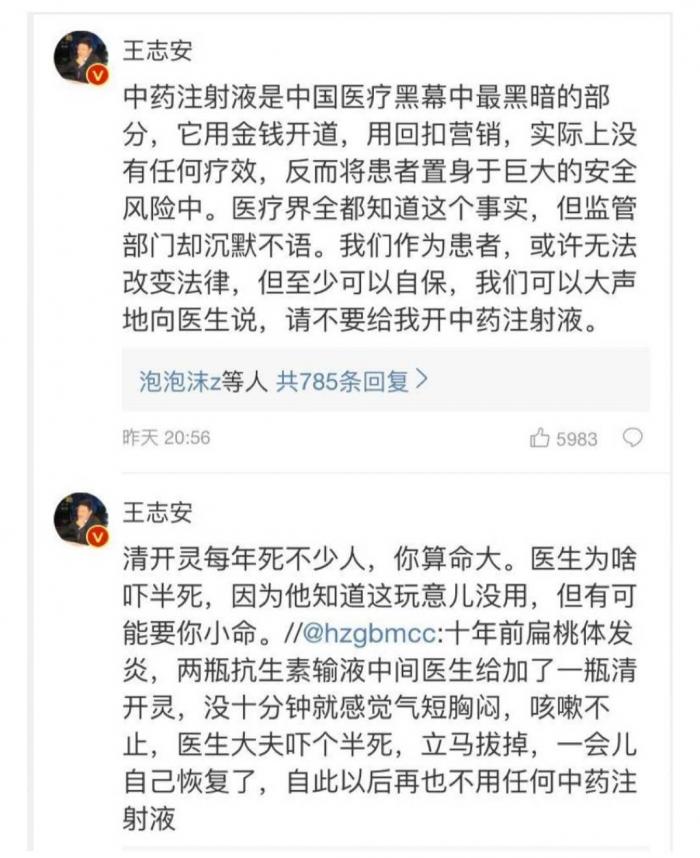
对于这些高销售量,王志安炮轰称,是用金钱开道,用回扣营销。
中药注射液频频发生的不良反应事件更是王志安炮轰中药注射液的原因所在。王志安指出,中药注射液由于里面有大量的大分子结构,过敏反应触目惊心,每年因为过敏而死亡的案例,都有许多起;给患者开中药注射液的医生,缺德!
中药注射液确实也出了不少事故。如2006年,“鱼腥草注射液导致严重不良反应甚至死亡事件”曾震动整个行业;2011年,苏中药业集团的生脉注射液被发现多起不良反应,后被召回三万余支注射液;2017年9月,红花注射剂和喜炎平注射剂四批次药品在山东、新疆、甘肃等多地注射后出现十多例寒战、发热等不良反应,被国家食药监总局紧急召回。
国家药品不良反应监测中心发布的《国家药品不良反应监测年度报告(2017年)》指出,2017年中药不良反应/事件报告中,注射剂和口服制剂所占比例分别是54.6%和37.6%;2017年中药严重不良反应/事件报告按照给药途径分布,静脉注射给药占84.1%。
实际上,由于中药材的质量受产地、气候、采收季节及加工炮制等多种因素的影响,因而同一种中药材的成分、含量及毒性也会有差异,不良反应发生率也会不同;另外,在原料方面,由于中草药来自纯天然,不可避免存在细菌污染的情况,当被细菌污染的中药注射剂进入人体时,会产生内毒素,会引发各种不良反应。
曾经因为生产技术的问题一直难以去除细菌内毒素,据研究报道,曾对某批次清开灵注射液进行细菌内毒素检查后,该批清开灵注射液的内毒素已经远远超过了药典规定至少5倍以上。
一位朋友说:“小时候打清开灵注射液立即有针水反应,后来只要一打针,我妈就提出不要打中药注射液,我因此逃过一劫。”
实际上,每次中药注射液出事或者国家出台对中药注射液的相关禁令后,一些企业的负责人会表示很不服,认为一些化药的不良反应实际上比中药注射剂的都要多,而且现在很多中药注射液的安全事故都是因为操作不当引起的。企业表示,这个锅太重,背不起。
有全国人大代表、药业董事长向21世纪经济报道记者表示,希望监管部门对中药注射剂的不良反应上报标准更加精细化,不因某地出现某一例不良反应而影响整个行业。对于中药注射剂安全再评价方面,希望监管部门给予明确规定及结果答复。
在取缔中药注射液的呼声越来越强的情况下,只有一条路:拿数据说话。
早在2007年国家药品监督管理局发布了《中药、天然药物注射剂基本技术要求》,2009年发布了《关于做好中药注射剂安全性再评价工作的通知》,2010年发布了《关于印发中药注射剂安全性再评价生产工艺评价等7个技术指导原则的通知》,以指导中药注射剂安全性再评价工作的开展。
2018年3月23日,原国家食品药品监督管理总局发布2017年度药品审评报告显示,2018年我国将研究启动中药注射剂再评价,制定再评价技术指导原则。
但由于种种原因,国家局有关文件落实工作推进缓慢。企业亦抱怨其研究成果无法得到认同,导致中药注射剂劣币驱逐良币的现象长期存在。
在2019年全国两会期间,全国人大代表、江苏康缘药业股份有限公司董事长肖伟等3名代表向十三届全国人大二次会议提交了《关于加快推进中药注射剂安全性有效性再评价的建议》,包括尽快制订中药注射剂再评价的工作目标和工作计划,使中药注射剂再评价工作能够顺利推进等,通过安全性再评价的品种,才具备进入临床有效性再评价的资格。
中药注射液去留,要拿数据说话,证明自身的安全性、不良反应率等。当然,此处也要@一下国家药监局,各方都在等待一个说法。