国产阿尔茨海默病新药上市,月费用约3580元,全球研究拟投30亿美元
记者从中国科学院上海药物研究所主办的九期一全球战略发布暨第一届脑肠轴论坛上获悉,我国原创治疗阿尔茨海默病(AD)新药甘露特钠胶囊(九期一,代号:GV-971)2019年12月29日正式在国内上市。患者可凭医生处方,在全国各大专业药房(DTP药房)购买。据悉,九期一规格150mg14粒3板定价为895元。按此计算,月费用约3580元(28天计算)。
定价出炉:月费用约3580元
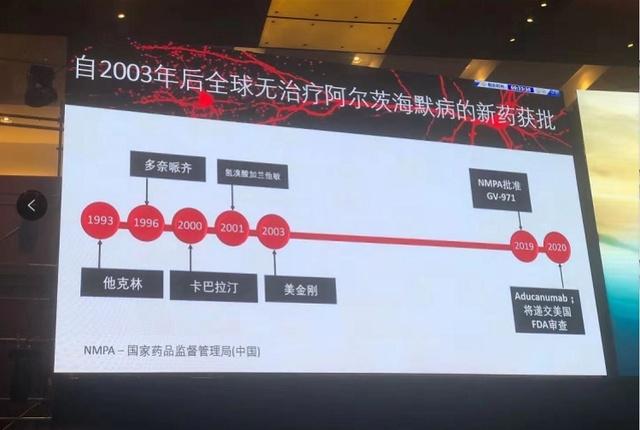
今年11月2日,国家药品监督管理局有条件批准九期一作为国家I类新药上市,“用于轻度至中度阿尔茨海默病,改善患者认知功能”。
该药是中国科学家原创、中国企业投入、拥有完全自主知识产权的治疗阿尔茨海默病新药,也是自2003年以来全球第一个被批准用于治疗阿尔茨海默病的药物。
九期一研发历时22年。新药上市申请从受理到获批不到1年,是国家药品审评审批制度改革后,通过优先审评审批通道获批的第一个神经精神类中国原创药物,为全球阿尔茨海默病患者提供了“中国处方”。
目前,国内治疗阿尔茨海默症的相关药物费用约为1500元/月。绿谷董事长吕松涛介绍,甘露特钠胶囊(商品名“九期一”)规格:150mg14粒3板定价为895元。按此计算,月费用约3580元(28天计算)。一个患者如果吃一年的话,费用大概是4万元左右,“我们争取未来能够进入国家医保。”
临床试验结果显示,九期一有效率为78%
九期一的研发得到了国家“863计划”、国家自然科学基金、国家“973计划”、“重大新药创制”国家科技重大专项、中国科学院战略性先导科技专项(A类)、上海市科技计划等项目的资助。
在九期一全球战略发布暨第一届脑肠轴论坛上,九期一中国3期临床主要牵头研究者、上海交通大学医学院附属精神卫生中心教授肖世富,九期一中国3期临床主要牵头研究者、北京协和医院神经医学科教授张振馨,系统公开解读了九期一临床研究数据与结果。
九期一进入临床试验以来,先后有1199例中国受试者分别参加了1、2、3期临床试验研究。其中3期临床试验由北京协和医院和上海交通大学医学院附属精神卫生中心牵头组织的全国34家三级甲等医院开展,共完成了818例受试者的服药观察。该药也是阿尔茨海默病药物领域全球首个长达9个月的纯安慰剂对照研究。
临床试验结果显示,九期一有效率为78%,可以持续、明显改善患者的认知功能,有效地抑制导致阿尔茨海默病的脑部神经炎症,且安全性好,不良事件发生率与安慰剂组相当。
北京协和医院神经医学科教授张振馨表示,GV-971可以改善轻度AD的认知损害,并可能延缓疾病进程。不过,由于三期临床研究只观察9个月,存在“天花板效应”,观察时间不足,加上测量量表对轻度患者不够敏感,可能导致GV-971对轻度AD的疗效显得不如中重度AD。
张振馨认为,临床观察GV-971有改善认知和功能损害,以及可能改变疾病进程的功效。目前虽然没有证据能够说GV-971根治AD,有待延长给药时间,调整剂量,进行标志物的研究,证实延缓疾病进程。
临床药物只有5款,发现新的药物作用机制
自发现阿尔茨海默病100多年来,全球用于临床治疗的药物只有5款。全球各大制药公司在过去的20多年里,相继投入数千亿美元研发新的阿尔茨海默病治疗药物,320余个进入临床研究的药物已宣告失败。
目前阿尔茨海默病的药物治疗只提供有限的获益,不会影响潜在的疾病进程。“虽然许多治疗阿尔茨海默病的药物试验都失败了,但每一次失败的临床试验都提供了如何进行更好试验的经验教训。”美国克利夫兰医学中心卢鲁沃脑健康中心主任教授杰弗里·卡明斯( Jeffrey Cummings)说。
据介绍,很长时间里大多数阿尔茨海默病药物的开发,都专注于靶向患者大脑中形成的β-淀粉样斑块,这些斑块被认为会干扰神经信号传导。但是,鉴于众多靶向淀粉样蛋白药物在临床试验中失败,越来越多的研究者开始探索其他策略。
九期一是以海洋褐藻提取物为原料,制备获得的低分子酸性寡糖化合物。临床前作用机制表明,九期一是通过重塑肠道菌群平衡,抑制肠道菌群特定代谢产物的异常增多,减少外周及中枢炎症,降低B-淀粉样蛋白沉积和Tau蛋白过度磷酸化,从而改善认知功能障碍。
针对九期一研究团队此前发表的论文,华盛顿大学圣路易斯医学院神经系统疾病中心主任、美国神经学协会主席戴威·霍茨曼(David Holtzman)及其同事在《细胞研究》(Cell Research)发表文章评论:“毫无疑问,这一(小鼠)数据进一步支持了新的理念,即通过GV-971(九期一)疗法或其他策略调节肠道菌群,应作为减缓阿尔茨海默病疾病进展的新策略做进一步探索。”
美国阿尔茨海默病协会期刊《阿尔茨海默病和痴呆症》的主编查文·哈恰图良(Zaven Khachaturian)表示,最重要的一点,可能是它印证了对肠道菌群(和)炎症的关联性,这是一个人们关注度越来越高的领域。“一旦我们深入了解了这种作用方式,我们将能够利用这些知识,通过合理的药物设计,生产出更有效的化合物来作用于这一靶标。”他说。
预计到2050年我国患病人数将超过4000万
阿尔茨海默病是发生于老年和老年前期、以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变,临床上表现为记忆障碍、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等。
《世界阿尔茨海默病2018年报告》显示,每3秒钟全球就有一名痴呆症患者产生。全球目前至少有5000万痴呆患者,预计2050年这个数字将达到1.52亿。其中,有约60%-70%为阿尔茨海默病患者2018年全球阿尔茨海默病患者的治疗及照护费用已达万亿美元。
在我国,目前约有1000万阿尔茨海默病患者,预计到2050年患病人数将超过4000万,比加拿大的总人口还要多。
快速增长的老龄人口和沉重的照护负担,是当下社会不得不面对的紧迫问题。2018年4月,北京宣武医院神经内科主任贾建平教授及其团队发表的《阿尔茨海默症在中国以及世界范围内疾病负担的重新评估》显示,在我国,阿尔茨海默病患者平均每人每年要花费13万元,其中超过67%是交通住宿费、家庭日常护理费等非直接医疗费用。
企业未来拟投入30亿美元,支持上市后真实世界研究
与九期一在中国上市同步,上海绿谷制药有限公司12月29日宣布,未来拟投入30亿美元,支持九期一上市后真实世界研究、国际多中心3期临床研究“绿色记忆”、扩大适应症研究和机制深入研究等。
其中,国际多中心3期临床研究,将以超过2000例轻、中度阿尔茨海默病患者为对象,在北美、欧盟、东欧、亚太等地区的200个临床中心开展12个月的双盲试验和6个月的开放期试验,在18个月的时间内观察药物的疗效,进一步深入验证九期一的临床价值。
“全球200个临床中心,2046例,中国占比可达40%。临床研究也将考虑对药物的适应症做拓展,包括针对预防AD、中重度AD、帕金森症开展研究。”绿谷方面负责全球临床研究的负责人表示,在国外的临床试验将直接进行3期试验,国外监管机构是认可中国三期临床数据的。
绿谷表示,他们计划2024年完成国际多中心临床试验,争取在2025年完成新药全球注册申报。
九期一国际多中心3期临床研究由美国阿尔茨海默病协会终身成就奖(2018)获得者、美国克利夫兰医学中心卢鲁沃脑健康中心主任教授杰弗里·卡明斯( Jeffrey Cummings)、领衔主导并担任首席科学家,他同时也是绿谷制药有限公司的科学决策委员会主席。
上海绿谷制药有限公司表示,将以开放、平等、共享、全球运作的规则设立开放性专项研究基金,支持全球优秀科学家共同参与“九期一”及其机理深入研究,以推动脑肠轴与大脑疾病共性机制的深度研究。
张振馨期待药物机制的研究可以更上一层楼,找到阿尔茨海默病的原因在哪里,哪些部位有病理改变,具体的致病环节是什么。
(来源:南方+)
(编辑:叶映橙)