国内市场迎来第二个PD-L1药物。
2月13日,罗氏制药宣布泰圣奇®(英文名:Tecentriq®,通用名:阿替利珠单抗atezolizumab)在国内获批上市,用于一线治疗广泛期小细胞肺癌的肿瘤免疫疗法。
这是继2019年12月10日,国家药监局批准阿斯利康旗下PD-L1药物Imfinzi上市后,国内获批的第二个PD-L1药物。
加上6个PD-1药品,目前国内上市的PD-1/L1药物达到了8个。
2019年营收18.75亿瑞士法郎
阿替利珠单抗是罗氏自主研发的用于肿瘤免疫治疗的创新单克隆抗体,通过和肿瘤细胞表面以及肿瘤浸润免疫细胞表面的PD-L1蛋白结合,帮助人体免疫系统识别肿瘤细胞,并进一步激活人体免疫系统T细胞攻击肿瘤细胞。
罗氏方面称,目前正在同步进行9个针对阿替利珠单抗的大型全球三期临床试验,如肝细胞癌、三阴性乳腺癌等领域。已经在美国、欧洲等地获批用于一线治疗特定非小细胞肺癌、三阴性乳腺癌等。
本次国家药品监督管理局批准阿替利珠单抗联合化疗用于一线治疗广泛期的小细胞肺癌,主要依据全球多中心三期临床试验IMpower133试验结果。该试验入组403名广泛期小细胞肺患者,随机分为两组,对比阿替利珠单抗联合化疗,与单一化疗治疗小细胞肺癌的疗效和安全。
根据该研究,对比化疗手段,泰圣奇联合化疗可以显著延长小细胞肺癌患者的总生存,降低该研究受试患者死亡风险30%。
IMpower133研究的中国主要研究者, CSCO小细胞肺癌专业委员会主任委员程颖表示,“泰圣奇联合化疗组的小细胞肺癌患者中位生存期为12.3个月,而化疗组患者仅为10.3个月。这是首次看到广泛期小细胞肺癌患者的的中位生存期超过一年。”
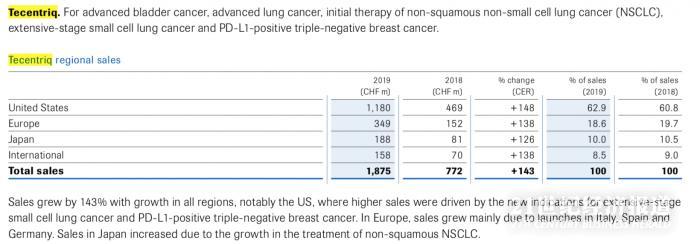
根据罗氏2019年财报,Tecentriq的适应症包括晚期膀胱癌、晚期肺癌、非鳞状非小细胞肺癌(NSCLC)的初始治疗、广泛期小细胞肺癌和PD-L1阳性三阴性乳腺癌等。
2019年罗氏制药销售额为485亿瑞士法郎(2018年为440亿瑞士法郎),增长11%。新产品Ocrevus,Hemlibra,Tecentriq和Perjeta是主要的增长动力,共同为新的销售贡献了44亿瑞士法郎(CER)。其中中国市场营收增长了36%,达到31亿瑞士法郎。
2019年Tecentriq全球营收18.75亿瑞士法郎,同比增长143%。
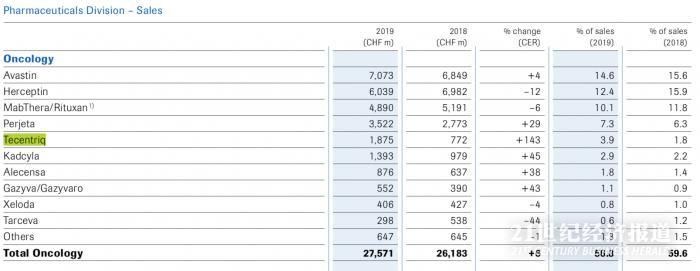
Tecentriq的销售在所有地区都有所增长,其中最大的贡献来自美国和欧洲的更高需求以及新推出的适应症。
得肺癌者得天下?
肺癌是中国发病率与死亡率最高的癌种,近年来中国肺癌发病还呈现出快速增长的趋势。肺癌根据病理类型,可以分为非小细胞肺癌和小细胞肺癌,其中小细胞肺癌约占肺癌的15%。小细胞肺癌是一种侵袭性强,增殖迅速的恶性肿瘤。
根据流行病学统计,小细胞肺癌与吸烟及二手烟暴露有密切关系,超过80%的小细胞肺癌患者有吸烟史。
小细胞肺癌患者的预后极差,有2/3的患者初诊时就已经到了广泛期,即疾病发现时候已出现了远端器官或淋巴结转移,确诊后 5 年平均生存率只有 2% 。目前化疗是广泛期小细胞肺癌最常见的临床治疗方案,但仅有20%的广泛期小细胞肺癌患者接受治疗后会出现症状完全缓解,往往很快又出现耐药,5年生存率极低。
Tecentriq小细胞肺癌获批后,罗氏表示在中国实现肺癌治疗的全覆盖,产品管线涵盖了针对EGFR突变非小细胞肺癌的特罗凯®,针对ALK阳性非小细胞肺癌的安圣莎®,以及靶向抗血管生成药物安维汀®。
肺癌同时也是几大免疫药物竞争最为激烈的“战场”。由于发病率和死亡率在全球都是第一位,谁能拿下肺癌更多的适应症就能获得更大的市场。
国内第一个上市的PD-L1药物Imfinzi,适应症为同步放化疗后未进展的不可切除、III期非小细胞肺癌。在肺癌领域,阿斯利康也有多个产品,“我们的目标是通过已经获批上市的药物易瑞沙(gefitinib)、泰瑞沙(osimertinib)和正在进行的III期临床试验,以及II期探索性组合试验,来解决EGFR突变肿瘤患者作为疾病遗传驱动基因的未满足需求,在美国和欧盟10-15%的NSCLC患者和亚洲30-40%的NSCLC患者都有EGFR突变。”
Imfinzi业内俗称“I药”,与默沙东的PD-1药物“K药”Keytruda(可瑞达)、BMS的“O药”Opdivo(欧狄沃),罗氏的PD-L1药物“T药”Tecentriq是全球最热门的四大免疫类药物。
全球第一个获批的PD-L1药物是罗氏的Tecentriq。2016年年中,美国食品和药物管理局(FDA)批准Tecentriq用于治疗最常见的膀胱癌,即局部晚期或转移性尿路上皮癌。据FDA,Tecentriq 是第一个被批准用于治疗这类癌症的 PD-1/PD-L1抑制剂。
一年后的2017年5月,Imfinzi由FDA批准用于局部晚期或转移性尿路上皮癌。2018年2月,FDA批准Imfinzi用于3期非小细胞肺癌(NSCLC)的患者。
2018年12月,阿斯利康在中国递交Imfinzi的上市申请。罗氏的Tecentriq同样也在中国提交了上市申请。后I药反超T药在国内获批上市。
目前全球共上市3款抗PD-L1全人单克隆抗体,包括阿斯利康的Imfinzi(durvalumab),罗氏的Tecentriq(atezolizumab),以及德国默克和辉瑞联合开发的Bavencio(avelumab)。
据Evaluate Pharma数据,2022年全球肿瘤治疗市场将达到1920亿美元,其中PD-1/ PD-L1贡献接近300亿美元,到2022年,Opdivo、Keytruda、Tecentriq的销售额将分别达到99.12亿、95.09亿和49.37亿美元,位列全球药品销售的第3、4和18位。
K药在国内不断拿下多个肺癌适应症。2019年11月26日,K药获批新适应症:联合化疗用于转移性鳞状非小细胞肺癌的一线治疗。自2018年7月第一个适应症获批上市,一年多以来,K药已经在华获批四个适应症,成为在国内及在晚期肺癌治疗领域获批适应症最多的PD-1单抗药物。根据默沙东2019财报,Keytruda全球销售额增长55%,达到111亿美元。