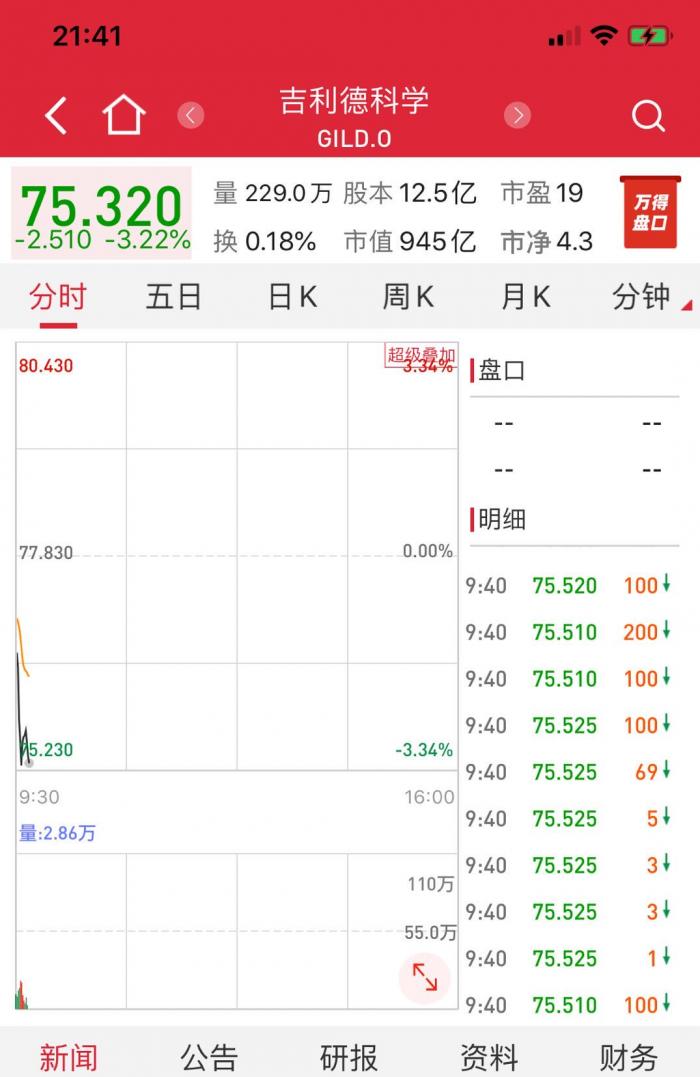
吉利德开盘跌3%。5天疗程临床改善65%,10天疗程未达到统计学显着性。
6月1日,美股盘前,吉利德宣布了瑞德西韦(Remdesivir)针对中度新冠肺炎(COVID-19)患者的3期临床试验结果:研究证明了其5天治疗过程相对于单独使用护理标准的治疗带来了显著的临床改善。
消息一出,吉利德科学(纳斯达克股票代码:GILD)盘前跌逾3%;截至北京时间21:41,盘中跌逾3%。
吉利德在公告中称,这项开放性研究评估了瑞德西韦加治疗标准的5天和10天疗程,与单独的治疗标准进行了比较。该研究表明,与标准治疗组相比,在第11天接受5天瑞德西韦治疗组的患者出现临床改善的可能性要高65%(OR 1.65 [95%CI 1.09-2.48]; p = 0.017)。瑞德西韦治疗10天疗程与标准护理相比,临床状态改善的几率也是有利的,趋于但未达到统计学显着性(OR 1.31 [95%CI 0.88-1.95];p = 0.18)。
在任何一个治疗组中,瑞德西韦均未发现新的安全信号。吉利德计划在未来几周内提交完整的数据,以便在同行评审的期刊上发表。
新闻稿中引用了一名哈佛医学院医学院副教授Francisco Marty的说法,“我们对SARS-CoV-2感染严重程度和COVID-19表现的理解不断发展。这些研究结果为瑞德西韦提供了更多令人鼓舞的数据,表明如果我们能够通过为期5天的治疗过程在疾病过程中进行早期干预,我们可以显着改善这些患者的临床结局。”
在全球范围内,目前瑞德西韦在日本已获准用于感染新冠病毒的患者。在日本以外的地区,瑞德西韦是一种未经批准的试验性药物。美国食品和药物管理局(FDA)授予remdesivir紧急使用许可,用于治疗重症COVID-19的住院患者;授权是暂时的,不能代替正式的新药申请提交,审查和批准过程。
紧急使用授权以两项全球临床试验的现有数据为基础美国国家过敏和传染病研究所(NIAID)对中度至重度新型冠状病毒肺炎患者(包括危重患者)进行的安慰剂对照的三期试验,以及吉利德公司的评估重症患者中瑞德西韦5天和10天给药时间的全球三期试验。
Gilead Sciences首席医学官Merdad Parsey解释,“我们现在有三个随机、对照的临床试验,证明瑞德西韦通过几种不同的方法改善了临床结果。如今的结果表明,在治疗中度患者时,瑞德西韦5天疗程比标准治疗带来了更大的临床改善,为先前发布的研究结果增加了有益的更多证据。”
此次公布的试验结果中,瑞德西韦在5天和10天治疗组中,普遍耐受良好。在两个治疗组中,超过5%的患者中最常见的不良事件为恶心、腹泻和头痛。
吉利德发起的SIMPLE试验包括针对重度和中度新冠肺炎患者。吉利德(Gilead)在COVID-19感染率高的国家/地区发起了两个随机、开放标签、多中心3期临床试验,这些研究在全球180多个试验地点进行,其中包括美国、中国、法国、德国、香港、意大利、日本、韩国、荷兰、新加坡、西班牙、瑞典、瑞士、台湾和美国英国。
此前针对重度患者的试验结果已经发表在《新英格兰医学杂志》上:该报告指出,与接受安慰剂的患者相比,接受瑞德西韦的患者的康复时间较短。该研究将康复定义为从医院出院或在医疗上足够稳定以至可以出院。接受瑞德西韦治疗的患者中位恢复时间为11天,接受安慰剂的患者为15天。
与标准治疗方法相比,第二项SIMPLE试验正在评估在中度COVID-19的住院患者中,静脉注射瑞德西韦5天和10天给药时间的安全性和有效性。该研究的初始阶段将600例患者按1:1的比例随机分配,除了单独接受标准治疗外,还接受瑞德西韦5天或10天疗程。研究增加了扩展阶段,以招募另外1000名中度疾病患者。扩展阶段的结果预计将在未来几个月内发布。
(作者:卢杉 编辑:李清宇)