FDA新药审评审批年度“成绩单”。
编者按:
2020年新冠疫情在全球的大流行重塑了医药行业,而创新能力突出的生物制药则试图在大流行中扮演终结者的角色,如疫情初期寻找抗病毒药物的如火如荼,后期多种技术路线下疫苗研发的百家争鸣。
不过,被视为“守门人”的各国药物审评审批机构,今年在政情与疫情的交织中是忙得焦头烂额。每年各国药品监管部门批准了多少新药进入市场,已成为各国药企和投资人下一步行动的指南,更主导着行业未来发展方向。
而2020更甚,因为这是一个史无前例的疫情全球大流行之年,人们深切地感受到了创新药物是公共卫生危机中保障生命安全的重要基石,而全球的药物研发企业和监管部门则受到全球各界罕见的高度关注。
而在全球药物市场中,对医药行业来说,中美是两个最重要的“风向标”。美国是全球药品审评审批制度最成熟、医药创新能力最强、药品消费能力最高的国家,而中国则是全球最大的新兴药物市场,同时也是药品审评审批制度改革力度最大的国家。可以说,这两个国家的市场可以说是全球跨国药企必争之地。
那么,在疫情之年,我们看看大洋两岸的中国和美国药品监管机构新药审评审批“成绩单”,看看他们是否因疫情侵袭而停步,看看他们今年与往年有什么不同?此外,又给整个生物制药行业带来什么影响和变化?
创新推动进步。2020年,美国食品药品监管总局(FDA)没有因为疫情放缓新药审批。
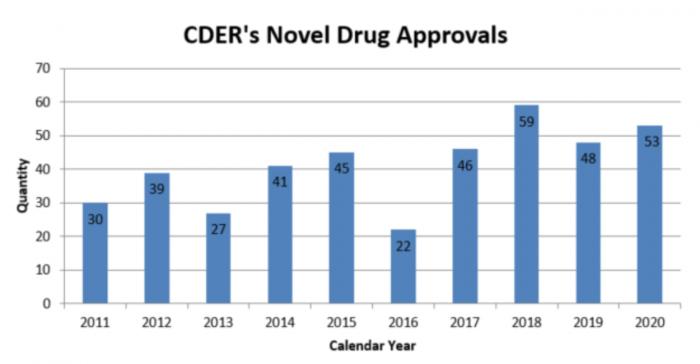
1月8日,作为全球新药审批的风向标,美国食品药品监管总局药物评估和研究中心(CDER, Center for Drug Evaluation and Research)发布了一年一度的新药批准报告,并在报告中陈述了在COVID-19大流行之下,创新对于监管和药物的重要性。FDA在2020年批准了53种新药上市,包括针对新冠的药物,成为FDA近十年来获批数量第二多的年份,仅次于2018年的59个药物。
尽管在突发传染病流行的情况下,FDA在审批抗疫药物、设备方面持续受到各方的质疑,但其仍旧是全球最为成熟和与时俱进的监管机构。
CDER将2020年度报告的主题定为“通过创新促进健康:新药疗法批准”,这是该中心连续第十年报告新药批准情况。
2020年,CDER批准了53种新药,它们分别是新药申请(NDAs)下的新分子实体(NME)或生物制剂许可申请(BLA)下的新治疗生物制剂。从2011年到2019年,CDER平均每年批准约40种新药。
图说:CDER近十年批准的新药数量 来源:FDA
FDA药物评估和研究中心代理主任Patrizia Cavazzoni在上述报告致辞中称,全年COVID-19大流行带来了前所未有的挑战,但仍旧有许多新疗法获批,包括首个用于治疗COVID-19患者的药物。“我们还批准了针对HIV-1、慢性丙型肝炎等抗病毒新疗法;神经学方面有治疗帕金森氏病、偏头痛和多发性硬化症的药物;心脏、血液、肾脏和内分泌疾病的进步上有包括针对患有心力衰竭,骨软化症和生长激素缺乏症的患者的新疗法。”
在这53种新药中,First-in-Class的有21种(占比40%),这些药物通常具有不同于现有疗法的作用机理。2020年批准的这些新药物包括:Blenrep,Enspryng,Ga 68PSMA-11,Imcivree,Inmazeb,Isturisa,Klisyri,Koselugo,Monjuvi,Nexletol,Oxlumo,Rukobia,Tauvid,Tazverik,Tepezza,Trodelvy ,Uplizna,Veklury,Winlevi,Xeglyze和Zokinvy。
在今年最受关注的传染病领域,除了批准吉利德的瑞德西韦用于治疗COVID-19患者,GSK的HIV药物Rukobia(fostemsavir)也获批上市,以及针对医院获得性细菌性肺炎和呼吸机相关细菌性肺炎的两种新疗法。其余较为罕见的是包括一种治疗严重疟疾患者、两种针对埃博拉病毒和一种针对Chagas病的新疗法,Chagas病是一种罕见的寄生虫病,可引起充血性心力衰竭:FDA批准的首个治疗两岁以下小儿患者的疗法。
在传统的大类抗肿瘤方面,2020有许多针对多种癌症的新疗法获批,尤其是肺癌,CDER批准了高达11种针对各种形式肺癌的新药。还批准了四种新疗法来治疗各种形式的乳腺癌患者。其他进展包括针对尿路上皮癌,大肠癌,前列腺癌和膀胱癌的患者的新疗法。
CDER还批准了多种新疗法来治疗罕见癌症患者,包括针对某些多发性骨髓瘤患者的三种值得注意的新疗法;一种新药用于治疗高危难治性或复发性神经母细胞瘤;两种用于治疗某些胃肠道间质瘤患者的新药,这是一种罕见的癌症,始于位于消化系统壁的专门神经细胞;治疗某些患有上皮样肉瘤的患者的新药,上皮样肉瘤是一种罕见的,缓慢增长的癌症,通常始于手指、前臂、小腿或足部皮肤下的软组织;治疗某些特定类型的转移性胆管癌患者的新药等等。
2020 FDA依旧延续了这几年重视罕见病的趋势:53种新药中有31种(占58%)被批准用于罕见疾病。2020年批准的带有孤儿药名称的新药是:青蒿琥酯,Ayvakit,Blenrep,Danyelza,Detectnet,Dojolvi,Ebanga,Enspryng,Evrysdi,Gavreto,Imcivree,Inmazeb,Inqovi,Isturisa,Koselugo,Lampit,Monjuvi,Orladeyo,Orladeyo Pemazyre,Qinlock,Retevmo,Sarclisa,Tabrecta,Tazverik,Tepezza,Tukysa,Uplizna,Viltepso,Zepzelca和Zokinvy。
比如治疗某些患有Hutchinson-Gilford早衰综合症的新药,某些基因突变导致过早衰老的罕见病,以及针对一种甲状腺眼病的新药,这种罕见的病症是眼后的肌肉和脂肪组织发炎,导致眼睛往前推并向外凸出。
Evrysdi(risdiplam)口服液粉末,用于治疗两个月或两个月以上的脊髓性肌萎缩症(SMA),这是一种罕见的且经常致命的遗传性疾病,会影响肌肉的力量和运动。这是FDA批准的第三种针对SMA的疗法,但只有一种经口服批准。
为了帮助检测和诊断疾病,CDER批准了三种新型诊断试剂,一种有助于评估患者的阿尔茨海默氏病,一种用于寻找生长激素抑制素受体阳性神经内分泌肿瘤,一种用于检测和定位前列腺癌。
Lampit(nifurtimox)片剂是一项加速批准的药物,是FDA批准的首个治疗小于2岁(从出生到18岁且体重至少2.5公斤)的恰加斯病的儿科患者的疗法。恰加斯病是一种罕见的寄生虫病,如果不及时治疗,会导致充血性心力衰竭。
Orladeyo(berotralstat)胶囊,用于治疗遗传性血管性水肿的一种罕见疾病,其特征是经常出现四肢,面部,肠道和气道反复发作的严重肿胀(血管性水肿)。
在审评审批方法上,CDER也频繁使用多种监管途径来提高效率,包括四大方式快速通道(53种新药中的17种,32%),突破性疗法(22种,42%),优先审评(30种,57%)和加速批准(12种,23%)。2020年的53种新药批准中有36种(68%)被指定为快速通道、突破、优先审评和/或加速批准中的一项或多项快速类别。
(作者:卢杉 编辑:徐旭)