谁是疫情终结者?
21世纪经济报道记者朱萍 实习生胡冰月 北京报道
抗新冠药物关注度持续升温。
不久前,默沙东新冠病毒口服药物Molnupiravir获批使用,随后辉瑞公布了新冠口服药物Paxlovid 的2/3期临床研究EPIC-HR的中期临床数据。中国也有相关布局并有初步成果,如开拓药业雄激素受体拮抗剂“普克鲁胺”获巴拉圭的紧急使用授权,并于10月底正式启动了重症住院患者三期临床试验;腾盛博药两种中和抗体药物则或将于12月底前获得批准附条件上市。
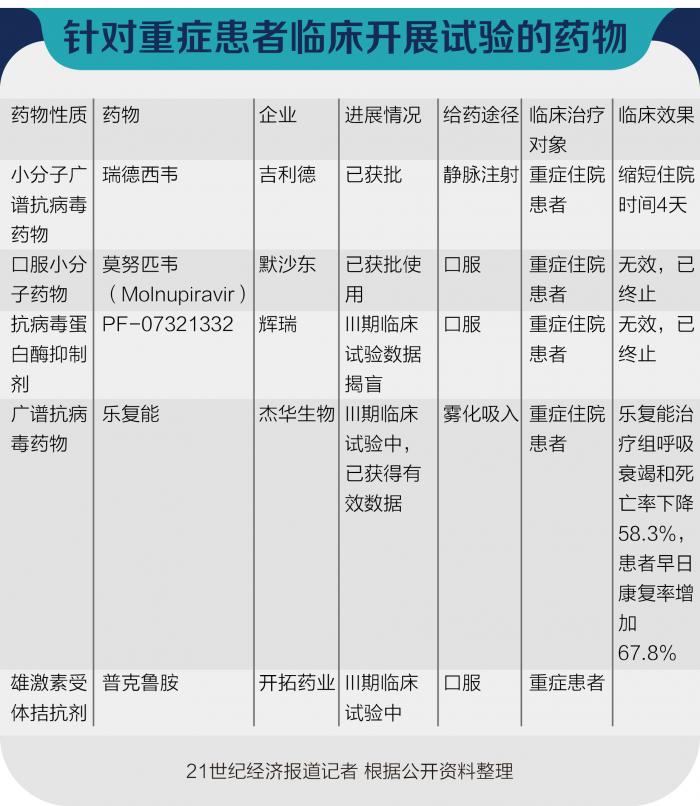
11月18日,21世纪经济报道记者独家获悉,杰华生物广谱抗病毒药物雾化吸入乐复能治疗重症新冠肺炎III期临床试验第一阶段(Cohort A)数据总结发布,目前其参与临床实验的国际团队正在撰写论文。数据显示,该药物可降低重症病人的呼吸衰竭和死亡率58.3%,乐复能治疗组无死亡病例;增加患者早日康复率67.8%;加快新冠病人体内病毒转阴,将重症病人病毒转阴时间从21天提前到7天;治疗第7天将病人体内病毒载量降低24倍。
当前,中和抗体、小分子口服药、广谱抗病毒药接踵而至,全球抗疫格局何时改变?在不久前的一次行业大会上,中国科学院院士、国家科技重大专项“重大新药创制”技术副总师陈凯先表示,在许多国家和地区疫苗接种已有一定覆盖率的情况下,仍引起新一轮疫情,这突显了抗新冠肺炎特效药物研发的重要性和紧迫感,特效药物是战胜疫情、消除恐慌、保护人类的终极武器。
谈到治疗药物的接踵而至,香港大学生物医学学院教授金冬雁向21世纪经济报道记者分析称,这将对防疫带来一定的帮助,但终究要靠疫苗,特别是新一代疫苗。“新冠疫情已经越来越象流感或普通感冒,全球的防疫策略也将随之改变。”
全球竞技
陈凯先表示,据不完全统计,当前临床在研的抗新冠药物有381个,其中上市申请4个、临床三期108个、临床二期180个、临床一期75个。
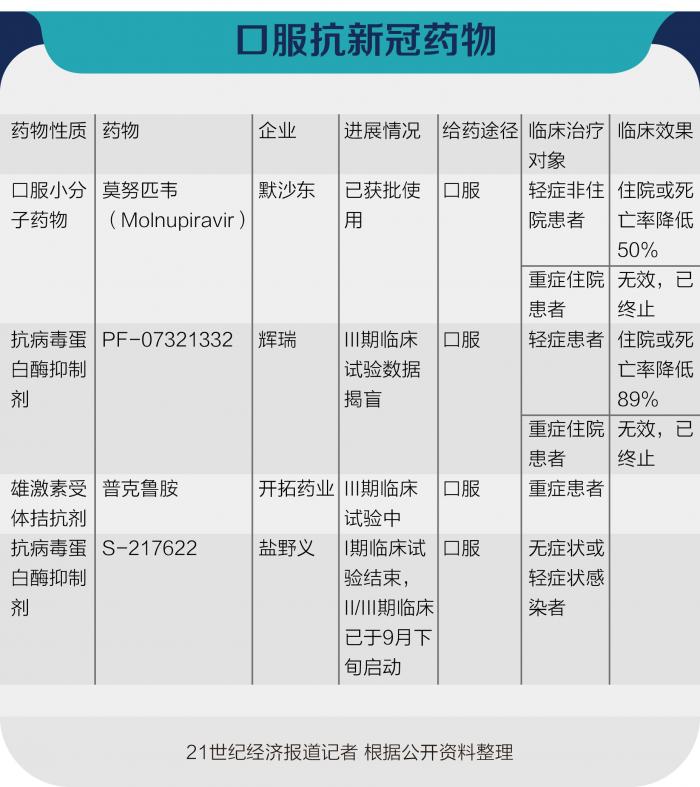
11月4日,美国药企默沙东的新冠口服药Molnupiravir在英国获批使用,成为全球首款用于治疗轻至中度新冠症状成年患者的获批口服抗病毒药物。目前,美国和欧盟正在加速审批,预计最快将于2021年底上市。数据显示,服用该药物的重症高风险患者的死亡或住院风险将降低50%。
仅一天后,辉瑞制药公布了其研发的新冠口服特效药Paxlovid临床试验结果。数据显示,该药物能将重症成人患者的住院风险或死亡几率减少89%。据了解,辉瑞公司将于11月25日前向美国政府提交紧急使用授权(EUA)申请,预计2022年初上市。
百济神州高级副总裁、化学研发负责人王志伟博士此前在接受21世纪经济报道记者采访时指出,大多数小分子药物可以口服给药,而且物制备工艺相对简单成熟,产量远远高于大分子生物药,成本也较大分子低;小分子药物储存、运输环境条件要求也较低,方便储存或运输。
据中信证券药品行业分析师甘坛焕介绍,相较于已上市的新冠治疗抗体类药物,Molnupiravir等小分子口服抗病毒药物具有几点优势:便捷性较强,患者口服即可无需前往医疗机构进行注射;治疗成本低,其整体治疗费用只有中和抗体药物的30%左右;产能瓶颈小,可迅速实现量产,可及性有望遍布全球;对突变株相对免疫,具有一定疗效;节省医疗资源,减轻医疗机构负担。
实际上,在Molnupiravir获批之前,在小分子药物领域,已有两款药获批上市或获批紧急使用,用于治疗新冠肺炎,即吉利德的瑞德西韦(注射液),以及礼来制药的巴瑞替尼(片剂)。
此外,还有被称为治疗新冠肺炎“特效药”的中和抗体近期也进展迅速,较早时期的是再生元(Regeneron)公司开发的中和抗体鸡尾酒疗法REGN-COV2、礼来和加拿大AbCellera公司联合开发的中和抗体LY-CoV555、VirBiotechnology和GSK联合开发的VIR-7831,三者均已进入以治疗为目的的II/III期临床试验阶段。
国内包括君实生物和中科院微生物所合作开发的JS016以及腾盛博药的BRII-196/BRII-198,还有国药集团正在研发的两款药物,分别是冠特异性免疫球蛋白和抗新冠病毒单克隆抗体等。其中,腾盛博药进展较快,已发布了其随机双盲对照的国际3期临床试验数据,在837例疾病进展高风险的新冠肺炎患者中,与安慰剂相比,单克隆抗体联合疗法使住院和死亡复合终点降低78%,
并拟在今年12月底前上市,腾盛博药相关负责人也向21世纪经济报道记者证实了该消息。
11月11日,义翘神州(301047.SZ)表示,疫情暴发以来,公司持续开发出一系列新冠病毒相关的生物试剂,其中部分生物试剂可以用于支持新冠特效治疗性药物的研发,如新冠病毒S蛋白,3CL蛋白酶试剂等。11月14日,翰宇药业发布了拟与中国科学院微生物研究所合作开发新冠病毒多肽鼻喷剂药物的消息。
再探“广谱”
其中,瑞德西韦有一定的争议性,虽已于2020年10年在美上市,但并没有得到WHO认可。2020年11月20日,WHO发布了一项有条件的建议:反对在住院患者中使用瑞德西韦。2020年10月15日世界卫生组织公布的瑞德西韦、羟氯喹等药物的临床试验结果,受试患者中,使用瑞德西韦的患者数量最多,达2750名。
但最终研究结果显示,从总体死亡率、接受呼吸机治疗时间及住院时间这些方面进行对比,这些试验用的药物全都“对新冠肺炎治疗收效甚微,或是根本没有效果”。
近日,21世纪经济报道记者发现中国也有一款“老药新用”的广谱抗病毒药物取得新进展。11月2日,杰华生物在其官网发布了抗病毒药物雾化吸入乐复能治疗重症新冠肺炎III期临床试验第一阶段数据。
乐复能,又称重组细胞因子基因衍生蛋白注射液,2018年5月25日正式获得国家药监局批准上市,用于治疗慢性乙肝。
2020年2月,乐复能中南大学湘雅医学院开展了一项评价雾化吸入清除新冠病毒的II期临床研究,该试验共入组观察89例普通型和重症新冠患者。研究结果显示,超过60%接受乐复能雾化吸入治疗的患者在6天内实现了新冠病毒转阴。
目前,乐复能获加拿大和日本特批直接开展Ⅲ期临床试验,正在全球13个国家、近百家医院进行,覆盖了从无症状感染者、轻型、普通型到重症的新冠病人,由第三方国际临床研究组织IQVIA负责相关临床试验事宜。
其中,乐复能治疗重症新冠的研究为随机、双盲、安慰剂对照的国际多中心III期临床试验,观察雾化吸入乐复能治疗住院的重症COVID-19患者的临床疗效与安全性。
ClincalTrials临床试验登记信息显示,这个研究分二阶段(Cohort A和Cohort B)独立进行,均为双盲设计,Cohort A观察初步安全性和有效性,参加临床研究的国家包括加拿大、巴西、南非、阿根廷、智利、秘鲁、肯尼亚、土耳其、印度尼西亚、乌克兰、马来西亚等十余个国家、约90多个中心。
第一阶段(Cohort A)设计入组40例左右,实际完成45例。Cohort A临床试验已经完成,数据分析报告提交独立数据委员会(DSMB)审查讨论,经DSMB确认的安全性和有效性数据正式揭盲。
第二阶段(Cohort B)临床试验设计入组约780例左右,现正在病人入组过程中。
从Cohort A的研究结果发现,乐复能针对新冠肺炎的重症治疗上,效果显著:乐复能治疗组7天病毒转阴,安慰剂组21天转阴,乐复能显示出较好的清除新冠病毒效果;乐复能治疗组与安慰剂组相比,降低重症病人的呼吸衰竭和死亡率近58.3%,死亡病例发生在安慰剂组,乐复能治疗组无死亡病例;乐复能治疗降低重症病人病毒载量效果显著,第7天乐复能治疗组比安慰剂组的病毒载量降低24倍(降低1.38 log10拷贝/毫升)。
杰华生物CEO刘龙斌向21世纪经济报道记者强调,所有数据均由第三方国际临床研究组织IQVIA按程序完成内部审核后,直接报告给国际知名专家组成的独立数据委员会(IDMB),IDMB讨论批准后,存档供药品监管机枸查证,再提供给企业。标准国际III期临床试验数据企业没有修改权利。
目前,针对无症状、轻型以及普通型新冠肺炎的III期临床试验亦在进行中。刘龙斌表示,“治疗无症状至普通型新冠的III期临床研究”于2021年8月紧急启动,中国科学院院士、国家感染性疾病临床医学研究中心主任、国务院联防联控机制科研攻关专家组专家王福生院士牵头,主要观察乐复能治疗后病毒转阴数据(以观察感染德尔塔变异株的患者为主),为探讨乐复能用于我国预防和治疗新冠的“防治结合”策略,提供科学数据和依据。预计入组病人200例左右,该研究正在进行中,主要收集口岸医院的患者,已观察20多例患者。
其中,关于“治疗非住院的轻型新冠的III期临床研究”,由日本研究者发起,刚获得日本厚生省旗下药监部门-PMDA紧急批准,预计入组200例左右,11月初启动。
另据了解,乐复能具有全球专利保护和市场准入权利,获得了从G7发达国家到G20国家、从北美、南美、非洲、亚洲到欧洲等10多个国家药监部门直接进行III期临床试验的批准。
国家卫健委及中医药局联合发布的《新型冠状病毒肺炎诊疗方案(试行第八版)》指出,在抗病毒药物应急性临床试用过程中,相继开展了多项临床试验,虽然仍未发现经严格“随机、双盲、安慰剂对照研究”证明有效的抗病毒药物,但某些药物经临床观察研究显示可能具有一定的治疗作用。目前较为一致的意见认为,具有潜在抗病毒作用的药物应在病程早期使用,建议重点应用于有重症高危因素及有重症倾向的患者。
作为“老药”,乐复能是否能真正扛起“广谱”大旗,仍待更多的验证。
全球抗疫何时胜利?
自疫情爆发以来,全球疫情已出现3轮反弹,均伴随着确诊人数的大规模增长。世界卫生组织总干事7月下旬表示,全球已进入“第三轮疫情的早期阶段”。在国内,2021年以来国内疫情出现多地散发的趋势,其中9月以来,福建、黑龙江等地则出现疫情多中心的特征,并且出现较多本土病例和关联病例。
实际上,之所以口服药物关注度极高,是因为新冠疫情对全球都产生了很大的影响,直接威胁着人类生命健康,耗费了大量的人力物力进行防疫,严重影响了全球经济发展等。
如为遏制疫情蔓延趋势,多个国家积极采取防控举措,对内限制或禁止群体活动,减少人群聚集风险;对外,实行边境控制,采取严格的旅行限制措施。为缓解新冠疫情对全球经济的冲击,一些国家的央行相继宣布降息等宽松货币政策和包括减税、投资、再融资等在内的积极的财政政策,以提振经济。
中国为防控疫情也投入巨大。自新冠疫情爆发以来,中国国内通过鼓励疫苗接种、加强区域管控、全员核酸检测和抗病毒药物等多种途径推动疫情防控工作。据原国家医保局医药服务管理司司长熊先军透露,截至2021年3月底,已向疫苗接种机构预付了240亿元。据国家卫生健康委官网消息,截至2021年11月16日,31个省(自治区、直辖市)和新疆生产建设兵团累计报告接种新冠病毒疫苗240289.7万剂次。
在刘龙斌看来,针对疫情防控主要有预防及治疗两道防线。
“第一道防线:以预防措施为主,主要依赖新冠疫苗,疫苗接种的首要目的为预防接种疫苗后的正常人群感染新冠病毒、以阻断新冠传播,次要目的为减轻新冠病人患病程度,减少重症和死亡,希望通过大规模接种疫苗,恢复正常社会经济生活。”刘龙斌向21世纪经济报道记者指出。
其次是第二道防线,以抗病毒治疗为主,主要依赖特效抗新冠病毒药物。特效药以“治”为主,也达到了“防”。清除病人体内的病毒后,病人不再具有传染性,不能成为传染源,既救治了病人, 也阻断了新冠传播。仅需对病人、密切接触者、高危人群提供特效药进行治疗和预防,极大减轻经济成本。如有特效抗新冠病毒药物,可以不通过封城的方式切断新冠流行,大大减少社会成本,维持正常社会和经济生活。对防控疫情具有重大意义。
对于中和抗体、小分子口服药、广谱抗病毒药物的到来,在香港大学生物医学学院教授金冬雁看来,这将对防疫带来一定的帮助,但终究要靠疫苗,特别是新一代疫苗。
实际上国内目前主张打出的是“疫苗+特效药”的组合拳。许多业内人士也认为,与单纯用一种方式相比,新冠抗病毒药物和新冠疫苗双管齐下更能达到理想的效果。
清华大学药学院院长、全球健康药物研究中心主任丁胜在接受21世纪经济报道记者采访时也指出,在当前疫情背景下,药物与疫苗不会是此消彼涨的状态,两者之间是互补。
“新冠特效药的问世,相当于与疫苗一起组成双保险,它并不能替代疫苗的作用。不能让人们都在感染后再去进行药物治疗,因为药物长期副作用和不良反应总是存在的,所以从这个角度而言,全世界采取的防控方式都是首先通过疫苗实现基础免疫。我觉得疫苗在终结疫情的过程中一定会发挥最重要的作用,这是对付传染病颠扑不破的真理。”国药集团中国生物首席科学家张云涛表示。
“疫苗接种率提高后封城越来越少,甚至绝迹。奥地利是对不打疫苗的人实施封闭令或居家令,新加坡规定不打疫苗的感染者自付医药费。实际上新冠疫情已经越来越象流感或普通感冒,没人会为流感搞大面积封城或大规模核酸检测,全球的防疫策略也将随之改变。”金冬雁向21世纪经济报道记者表示。
(作者:朱萍,实习生,胡冰月 编辑:包芳鸣)
21世纪经济报道及其客户端所刊载内容的知识产权均属广东二十一世纪环球经济报社所有。未经书面授权,任何人不得以任何方式使用。详情或获取授权信息请点击此处。