4月11日,国家药监局药审中心发布公开征求《双特异性抗体类抗肿瘤药物临床研发技术指导原则》意见的通知,形成征求意见稿,供药物研发相关人员参考。
21世纪经济报道记者 唐唯珂 实习生 鹿思佳 广州报道
4月11日,国家药监局药审中心发布公开征求《双特异性抗体类抗肿瘤药物临床研发技术指导原则》(以下简称“意见稿”)意见的通知,形成征求意见稿,供药物研发相关人员参考。
由于针对多个抗原的双特异抗体结构与功能存在特殊性,意见稿就临床试验风险控制、最佳给药策略的确定、临床试验设计、免疫原性、生物标志物开发等方面提出了需要特别关注的问题,帮助企业科学地开展临床研究。
此前即有业内人士向21世纪经济报道记者指出,目前国内双抗药物的产业链集中在中上游环节,众多企业通过研发外包服务降低研发成本,影响上游的主要因素为生物反应器的类型及培养条件。同时,由于双特异性抗体易引起聚合体情况,对抗体的纯化提出更高要求。
在4月15日-4月22日为全国肿瘤防治宣传周,国家药品监督管理局药品审评中心化药临床一部部长杨志敏指出,新药开发始终要以患者需求为导向,并建议需要加强对肿瘤疾病学的全面认识,在患者选择中要考量精准人群分型,要通过应用科学工具助力新药研发等。
双抗肿瘤药布局密集
恶性肿瘤的发生、发展具有复杂的病理组织学和分子生物学机制, 因此针对单一靶点的单 克隆抗体(monospecific antibody,以下称为“单抗”)往往不足以充分发挥足够的治疗效果。双特异性抗体(bispecific antibody,BsAb,以下称为“双抗”)是通过细胞融合或重组DNA技术制备的人工抗体,可以同时特异性结合两种抗原或同一抗原的两个不同表位。
近年来,随着多个双抗类药物的成功上市,引发了医药界对双抗类药物的研发热情;生物制药技术的发展,进一步推动双抗类药物进入高速发展阶段,尤其是在肿瘤治疗领域,双抗药物研发呈现持续增长。
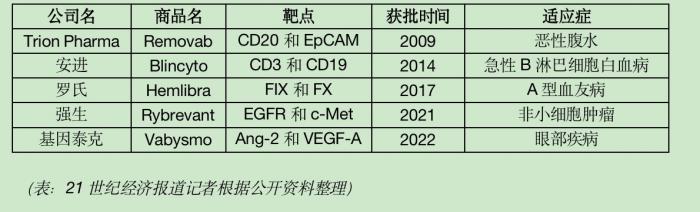
目前,全球已有5款双抗药物获批上市。分别是Removab、Blincyto、Hemlibra、Rybrevant、Vabysmo,其中Removab由于上市后销售不佳2017年退市。从适应症看,已上市的双抗药物适应症广泛,涉及肿瘤、罕见病以及眼科疾病等。
目前有2个进口品种在国内上市,罗氏的Hemlibra和百济神州代理安进的Blincyto。国联证券研报显示,Hemlibra使用的费用为136万(首年)/126万(次年)(按60kg体重估算),Blincyto的使用费用超过50万/42天,比现有单抗的费用明显要高。
目前国内市场也有不少双抗药品处于临床阶段。百济神州与安进、Zymeworks合作获取12个双抗项目,有2个处于临床阶段;信达生物已披露双抗研发产品达7个,有3个进入临床阶段;康方生物拥有5个双抗产品,2个进入临床,3个处于临床前;康宁杰瑞有2个双抗产品进入临床阶段。
业内人士预测,随着国内药物研发的逐步推进,未来3-5年或将迎来双抗药物上市井喷。
国联证券研究所预计,2030年中国的双抗市场将达到108亿美元,2024-2030年增速54.3%;单抗市场规模将达到579亿美元,2024-2030年增速16.7%。双抗行业增速高于单抗。
与单克隆抗体相比,双抗增加了一个特异性抗原结合位点,因而特异性更强、能更准确靶向肿瘤细胞并降低脱靶毒性,但双抗药物的开发复杂性更高,技术壁垒更高,对于技术平台和靶点选择的适配性要求更高。
正如《意见稿》所强调的,双抗研发需进一步为创新清障,注重以临床需求为导向的设计与开发思路。双抗靶点布局的集中,也意味着未来赛道竞争会愈发激烈,寻求产品差异化、减少同质化竞争,调整经营策略、探寻新的商业化模式也是药企需要思考的方向。
指导政策不断落地
随着对肿瘤发生发展的分子机制研究不断深入,近年来,新型抗肿瘤药物的研发和审批均得到科学依据的有力支撑。
2021年11月19日,国家药监局药审中心发布关于《以临床价值为导向的抗肿瘤药物临床研发指导原则》(以下简称“指导原则”),明确了以临床价值为导向的创新药开发方向,推动医药企业研发模式加速迈向FIC(first-in-class,同类首创)领域。
《指导原则》明确指出抗肿瘤药物的研发,从研发立题、到开展临床试验设计,都应从患者需求出发,而不仅仅是患者反馈的收集和量表的开发。
从确立研发立题来看,《指导原则》指出药企不仅需要药企倾听患者声音,也需要加强机制研究、提高精准化治疗、关注患者治疗需求的变化、从而不断改善药物的安全性和治疗体验与便利性。
从临床试验设计来看,《指导原则》指出抗肿瘤药物在选择阳性药作为参照时,应关注该阳性药是否反映和代表了目标适应症患者最佳用药情况,而不应该为提高临床试验成功率和试验的成功率,选择安全性或有效性不确定,或已被更优的药物所替代的治疗手段。
业内普遍认为,《指导原则》正式执行,短期来看会加大药企新药开发的难度,细分领域的研发赛道或许将不会再像当前这般拥挤,打击“伪创新”。而从中长期来看,在《指导原则》的指引下,势必将加速创新药领域的产能出清,引导企业实现“真创新”。
为进一步规范新型抗肿瘤药物临床应用,2021年12月27日,国家卫生健康委组织国家卫生健康委合理用药专家委员会牵头对《新型抗肿瘤药物临床应用指导原则(2020年版)》进行修改完善,制定了《新型抗肿瘤药物临床应用指导原则(2021年版)》,指出抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿和疾病预后三大要素;抗肿瘤药物临床应用是否合理,基于以下两方面:有无抗肿瘤药物应用指征、选用的品种及给药方案是否适宜。
面对大量新型抗肿瘤药物涌上市场,明确药物应用原则、指征及给用方案,进一步修订《新型抗肿瘤药物临床应用指导原则(2021年版)》,为规范抗肿瘤药物的临床合理应用提供了权威性指南,对政府药物集采和医保准入谈判也具有明确指导意义。
抗肿瘤药新时代:精准免疫、靶向治疗
中商情报网数据显示,近年来,全球癌症呈高发趋势,年新发患者数量从2016年的1720万人增加至2020年的1930万人,并且预计2025年将达到2160万人。
我国癌症患者人数众多,国家癌症中心2019年公布的数据显示,我国恶性肿瘤死亡占居民全部死因的23.91%,癌症已经成为我国第一大死因。
近些年,得益于鼓励药品研发创新、抗癌药进口零关税以及加强重大疾病医保谈判等政策,我国抗肿瘤药市场销售额较快增长。米内网统计数据显示,2020年因新冠疫情影响,我国药品终端市场呈现负增长,因此我国抗肿瘤用药在我国医药市场中占比快速提升,由2016年的6.35%上升至2020年的10.01%。
米内网数据同时显示,受患病率持续上升、抗肿瘤创新药不断推出、国家加大抗肿瘤药报销力度等因素的推动,2016-2020年我国抗肿瘤药的销售额持续上升,由863.62亿元上升至1458.74亿元,复合增长率达14.00%。
中国工程院院士、中国医学科学院肿瘤医院、国家肿瘤质控中心、国家新药(抗肿瘤)临床研究中心主任徐兵河此前介绍,我国抗肿瘤新药研发已经走过了从无到有,从仿制到创新的艰难过程,新药研发已进入全球第二梯队,在很多热门领域紧跟国际研发趋势,但也存在源头创新不足、新药研发赛道过于集中等问题,需要今后着力解决。
目前,在中国,用于癌症治疗的药物主要包括化疗药物、靶向药物及肿瘤免疫治疗药物。目前,以临床需求作为创新驱动,抗肿瘤药迎来靶向治疗和免疫治疗新时代。
PDB药物综合数据库显示,靶向小分子药物2021年全国样本医院销售额为83.7亿元,2012年至2021年复合增长率为24.56%;抗癌症免疫调节剂2021年销售额为74.4亿元,2012年至2021年复合增长率为22.03%。
肿瘤周策划《癌症防治 早早行动》
策划:于晓娜 朱萍
统筹:朱萍 徐旭
记者:朱萍 唐唯珂 季媛媛 武瑛港 魏笑
出品:21世纪新健康研究院
(作者:唐唯珂 编辑:朱萍)
21世纪经济报道及其客户端所刊载内容的知识产权均属广东二十一世纪环球经济报社所有。未经书面授权,任何人不得以任何方式使用。详情或获取授权信息请点击此处。